화공열역학에서 아주 중요한 등장인물이기 때문에 엔탈피에 대해서 자세하게 알아봅시다.

엔탈피는 압력이 일정한 상태에서 시스템에 출입한 열, Qp 를 말해요.
그리고, 엔탈피는 물질이 가진 모든 에너지의 합이므로, 절대값을 측정이 불가능하며, 그 변화량만 측정가능해요.
그리고, 엔탈피 H=U+PV로 정의합니다.
닫힌계의 열역학 제1법칙으로 부터 dU = dQ + dW, dU = dQ - PdV, dU = dQp - PdV (for constant pressure)
Qp는 압력이 일정한 상태에서 출입한 열이므로 엔탈피H로 바꿔 쓰면,
dU = dH - PdV dH = dU + PdV로 나타낼 수 있어요.
그리고, 엔탈피는 상태함수에요.
그렇기 때문에 헤스의 법칙을 사용해서 반응엔탈피도 구하고 하는 거에요.
이와 관련된 내용은 열화학 배울 때 다루기로 하고 넘어 갑시다.
엔탈피는 크기성질이에요. 그래서 엔탈피를 계산할 때, 몰수나 질량을 고려해야 합니다.
그리고 엔탈피를 다르게 표현하면, dH = dQp 이고 dQp = nCp dT로 쓸 수 있어요.
이 식을 정리하면, CP에 대해서 새롭게 정의할 수 있습니다.

그리고, 이와 유사하게 CV 에 대해서도 새롭게 정의할 수 있어요.
dU=dQV =nCV dT 이고, 이 식을 CV 에 대해서 정리하면
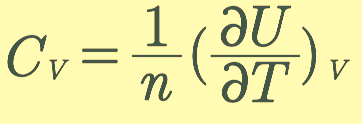
로 정의할 수 있어요.
정압비열, 정적비열에 대해서 넘어갔던 부분인데, 다시 돌아가서 보죠.
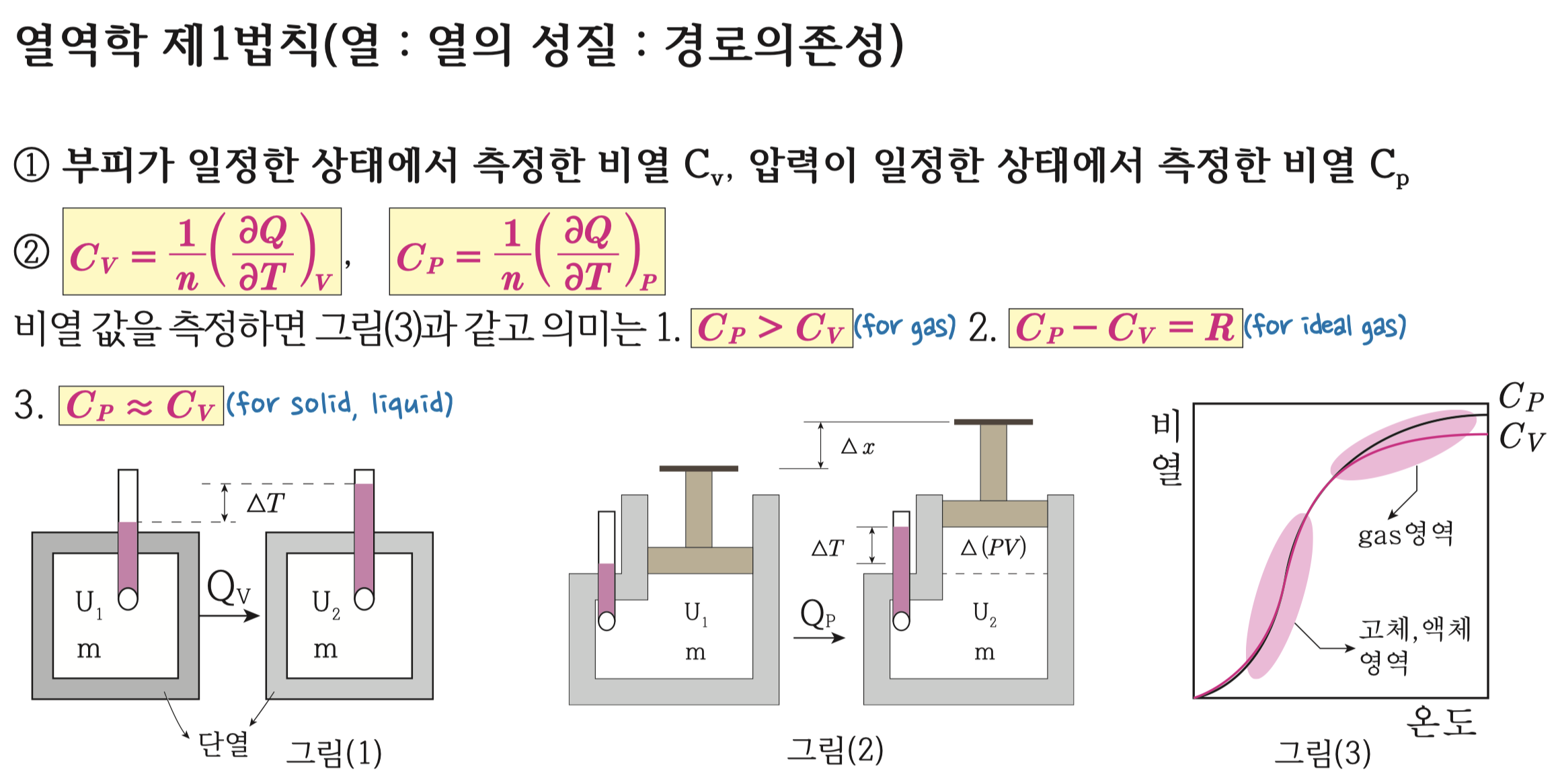
기체의 경우 Cp가 Cv보다 크다고 했었죠? 왜그럴까요?
위에서 좌측 그림과 우측 그림에서 질량m인 시스템에 열을 가해서 ∆T만큼의 온도를 올려보면,
좌측에 있는 부피가 일정한 열량계(그림1)의 경우에는 가해진 모든 열이 온도를 높이는데 쓰이지만,
우측에 있는 압력이 일정한 열량계의 경우(그림2)에는 가해진 열이 온도를 높이는데도 쓰이고,
팽창일에도 쓰이기 때문에 더 많은 열이 필요한거에요.
그래서 Qv 보다 Qp 가 큰거고, Cv 보다 Cp 가 큰거에요.
< 엔탈피와 내부에너지간 관계 >
이번엔 엔탈피와 내부에너지의 관계에 대해서 살펴봅시다.

닫힌계에 대한 열역학 제1법칙의 표현이죠? dU=dQ+dW
일의 정의로부터 dW = -PdV로 바꿔쓰면
dU=dQ-PdV 일정압력하에서, dQ=dQP 이므로, dU=dQP
-PdV dQP =dH 로 바꿔쓸 수 있고, dH에 대해서 정리하면,
dH = dU +PdV이고, 이상기체에 대해서 PV=nRT인데,
압력은 일정한 상수이므로, 이 식을 미분하면, PdV=nRdT가 되고,
이 식을 위 식에 대입하면 dH=dU-nRdT로 정리가 됩니다.
dH = dU +PdV식을 적분하면, ∆H=∆U+P∆V로 정리됩니다.
고체나 액체의 경우에는 부피변화는 무시할 정도로 작으므로 ∆V=0이 되고, ∆H=∆U가 됩니다.
이상기체의 경우는 ∆H=∆U-(∆ngas )RT 로 정리됩니다.
이 식은 기체가 생성되는 화학반응에서 엔탈피와 내부에너지의 관 계를 묻는 문제로 자주 출제되니까 꼭 암기하시기 바랍니다.
'화공열역학 > 기타(정리중)' 카테고리의 다른 글
| 9. 열역학 제1법칙(이상기체의 공정별 에너지 변화) (3) | 2021.08.12 |
|---|---|
| 7. 열역학 제1법칙(내부에너지의 성질) (1) | 2021.08.09 |
| 6. 열역학 제1법칙(열과 일의 관계 : 쥴의 실험) (0) | 2021.08.09 |
| 5. 열역학 제1법칙(열 : 열의 성질) (0) | 2021.08.08 |
| 4. 열역학 제1법칙(일 : 최대 비팽창일 non PV work) (0) | 2021.08.08 |